物理科学探疑-电磁理论与原子论-物质的温度与化学反应
![]()
化学反应与物质的温度
志勰
本文探讨了采用力学的方法去处理化学问题的可行性,应该是一篇采用力学处理化学问题的定性分析。本文也针对力学的方法提出新的观念。化学反应的低温环境和高温环境是采用传统化学的方法不能合理处理的两个领域。在低温领域,两种可以发生化学反应的物质可以并存,化学的价键模式不能提供此类的依据。对于高温领域,存在违反能量守恒定律的可能,并可以通过实验进行检验。
本文采用力学的方法提出化学物质分子可能性的结构、解构模式。本文的目的是——化学和物理研究物质运动的方法通过力学进行统一可能性的尝试。
物质间发生的化学反应过程,采用化学的解释方法已经较为完善了。几乎可以解释所有的化学现象。但是,化学中对物质间发生的反应过程,都是采用微观物质原子间的分解与组合进行定性定量的解释。虽然在化学中引入量子论的方法,去解释化学分子结构,这仍然是化学的方法。但我们不能否认的化学反应过程是物质的运动变化过程,不论是化学反应的本身还是化学反应过程的运动变化形式,都应该遵守物质运动变化规律。力学是解释物质运动变化原因的非常有效的方法,如果不将化学反应的本身归于力学的形式,那么,对于化学本身的解释而言至少不是最基本的。
将化学反应过程归结为物质运动变化本身在几个世纪以前就已经存在这方面的思想。但是直到一个世纪以前,建立物质宏观的单位质量与微观个体间对应的关系——摩尔的量之后,才具有实际物质运动变化原理的意义。但是,由于化学是建立在大量的化学试验的基础上,并且在历史上长期采用 不同的质的描述方法,直至今天,在谈到化学元素的时候,大多数的人士会将它当作物质中不同质的东西。甚至有很明显的界限。在对存在于世界的物质种类的判断中。这和物质原子和分子构成多姿多彩的物质世界是分不开的,这就给我们的主观判断提供了最初的判断形式。
化学反应过程是物质分子间原子的解构与重组的过程,这已经得到了大家的公认。但是是什么原因使物质进行解构与结构呢?恐怕大多数的同志会依据核外电子的得失方案,根据原子间的键价结构进行判断。这样的解释方案并不能提供给我们原子在解构与结构中发生状态变化的最直接的原因。现行对此的解释都是建立在原子量子的基础上,我们只能得到化学反应前后的各个量间的变化关系。并采用原子结构模式对化学过程有个大概的了解。至于为什么,那就是根据化学试验和化学原理所得到的经验约定吧。现在对化学反应变化的主要依据依然是元素周期律。
我们所接触的化学反应在物理的客观条件上是很有限度的。把化学反应过程扩展到物理的领域(物质世界的原理),那么,我们将会发现采用化学中的元素周期律进行解释,有一部分领域是不能合理的解释的。可以通过实验进行检验的两个区域是低温区域和高温区域。
另一方面,将化学反应过程从力学的角度来看,会有一些结论和化学中传统的解释是不同的。并且数理的逻辑关系和采用力学的解释会存在分歧,这是可以通过实验进行检验的。归根结底,两种对化学物质看法的不同来源于两个系统的定义的不同。您将会逐渐看到两种方法的歧义。
形成两种定义体系对两种解释方法的原因
传统化学中采用的解释方法是基于物理学中能量定义方法。近一个世纪以来,科学一直是继承性的发展,物理学中的概念很自然的被化学家应用与化学的领域。在微观物质世界的状态判定上,物理中的分子运动论是首要的对微观物质运动变化的解释条件。在微观与宏观物质的对应关系中,其中摩尔质量单位就是一个很明显的例证。但是,微观物质世界不能提供给我们直观的物质运动模式,我们不能根据日常生活中对事物经验判定方法对微观物质进行处理。另一方面,在当时,能量守恒定律的建立提供给人们这样一种模式,建立物质运动变化的数理关系,就可以对物质前后两种运动变化状态进行求解。这样有利于通过建立某种关于物质运动变化的数理模式对微观物质运动变化求解,这也是化学中通过建立键能等化学的数理逻辑概念的可行性的原因之一。这样我们只要确立物质分子与能量相关的物质运动变化状态的数理逻辑关系,就可以找到相应的与微观物质等同的数理量的状态,就可以对微观物质个体间进行求解。
传统化学中这样的应用是很成功的,并且采用理论与实验相互对应的方法。我们几乎可以解释在我们所接触的化学环境中所有的化学反应。
对于化学物质运动变化形成的物质种类的变化以及元素属性的规律,元素周期律已经可以很成功的给与解释,甚至可以很成功的预言未知元素。我们不能否认,这样的解释是建立在化学的数理逻辑上的经验约定,更确切的说,是理论与实验的相互矫正。如:超重元素的发现我们进一步让我们知道元素周期律的正确性,同时根据元素周期律赋予元素的属性,让我们去发现未知的元素。
但是这对于我们研究微观物体的结构与微观个体的属性来说,采用这种方法去解释微观个体的运动变化和结构状态。我认为这对于解释微观物质运动变化来说,这种方法并不是很合适的。微观物质和宏观物质同样都是物质,也许在我们对他们进行描述的时候,空间的大小、物质的结构会存在差异,但是物质的本身的实体是相同的,我们不能因为空间大小和物质结构的不同,就将物质的不同划分到另类的解释中,我认为在力学的解释上,力使物质发生运动状态变化,不论在微观还是宏观上来说,其本质是一样的。
我们仍然可以找到和宏观力学中相类似的解释方法,必须采用合适的对微观物质本身的定义角度,并对物质进行定义。这和宏观对物理事件的解释应该是没有多大区别的。这样的处理结果是根据微观物质的实际情况进行相应的解释。
力学的可行性的结构模式
不论我们采用哪一种对微观物质的解释模式,但必须基于这样的前提下:就是必须在物质发生运动变化时正确的反映物质运动状态的变化。
传统对此方面的解释是采用数理的方法,可以说不去考虑物质运动状态的变化过程,而只去考虑两种运动状态间所反映出的的反应前后变化关系。这样处理的方法是没有物质的运动变化过程。
如果我们研究的主体是物质的运动变化,那么,物质间的运动变化过程是必须的。在物理科学中,一个世纪以前我们已经否决了超距作用,我想大家也不会反对这样一个结论,没有变化过程的物质运动变化是不存在的。这是以物质本体的角度对微观物质事件的处理结果。
如果我们要考虑物质运动的变化过程,那就必须从引起物质运动变化的原因着手,这样就必不可少的要涉及到力的形式。采用力的方法去处理。我们必须放弃掉传统化学中的采用数理的形式和物质的种类对化学反应过程进行解释的方法。而采用物质的本身实体进行描述的方法。
两种微观物质粒子间的结合状态,是采用力学的解释模式首先处理的问题。对于这个问题,通过可行性的约定去处理,如量子论中采用价键结构去处理和采用数理关系去描述是具有可行性的。我们不能想象没有没有运动过程的物质运动变化,(没有运动变化过程同时意味着没有运动变化的时间,或者说不需要时间,也就是类似的超距作用)如果我们设想物质在运动变化过程中存在运动变化过程,如果物质是实体,那么,物质运动变化过程的本身就一定是由力引起的。这样我们必须通过力的作用对物质运动变化过程进行处理。
我们即使采用价键的结构,去处理物质微观分子的存在状态。除了我们必须强调分子中的原子间的分解与组合在化学反应过程中需要时间之外,在物质运动变化的形式上,和传统物理学中的解释仍然可以是相似的。但这样处理的结果是将分子中原子之间的结合力归于原子的势能上。传统物理学中的解释对此已经有了较为详细的研究,势垒的概念通常也是解释分子中原子间相互结合力的一种有效的方法。但是,传统物理学中对原子间分解与组合的处理方法并不是很明确的,这得自于采用数理描述体系,即量子论的描述方法。依据这种规律,我们不能找到与物质运动变化过程相对应的描述,而只能描述化学反应前后两种物质的运动状态。
将分子中原子的分解与组合看作是分子中的原子间的相对势能在空间位置上的结构变化是能让人满意的。在这种意义上来说,传统物理学中对此的解释基本上是正确的,但是只是在计量方法上,由于传统物理学采用了量子的计量方法,因此对物质运动变化的本身的描述不是很确切的,或者说我们不能采用这种方法对物质运动变化的本身进行处理。在这样的结构模式上,我们应该采用什么样的模式呢?
导致化学分子中的原子发生分解与组合的现象,采用力学的角度已经判定为解释物质运动过程的有效方法。分子间的结构在这里也已经假设为是由原子间的相对势能状态所确定,下一步我们必须确定是什么形式或方式的力使分子发生分解与组合。
采用力学的方法处理化学物质分解与组合的可行性
如果两种分子间发生化学反应,那么,发生反应的分子间必然发生原子的分解与组合。那么,两种分子发生化学反应以前,必然有两种分子间的相互作用。在化学反应的可以发生的前提上(两种分子必然可以发生化学反应,这一点可以根据化学分子的价键结构以及键能来判断。或者根据元素周期律),仍然存在特定的物理条件——温度。另一方面就是两种分子必须在可以相互接触下才有可能发生化学反应。
物质的温度是物质分子运动状态的一种标度。同种物质分子确定的温度对应着这种分子的特定运动状态。我们根据化学反应的发生必然存在的确定的温度可以判断,物质发生化学反应必然存在两种分子间存在特定的相对运动状态。这是经验事实,到目前为止,还没有哪一种物质发生化学反应不需要特定的温度,即便是在常温下可以发生剧烈反映的两种物质,比如钾和水的反应,在温度降低到一定程度,两种物质间可以并存,不会发生化学反应。关于这样一个经验事实我想应该对所有的物质都是成立的。
这说明物质间的化学反应在相互反应的两种分子之间必然存在确定的相对运动状态,或者换句话说存在相对动量。两种分子间存在的相会速度必然会有两种分子间存在的相对动量,从力学的角度,两种分子间发生的化学反应必然在两种相互反应的化学物质分子之间,存在确定的相对动量或冲量。这两种量在数值上是相等的,但是冲量描述的是总体的量,虽然对于微观物质分子描述来说,这两种量在对反应过程中的描述具有等效性,考虑到冲量与时间的关系,我认为采用相对动量的描述更为合理。(关于相对动量的定义以及实际的应用,您可以参见机械运动中的能量体系中的一维弹性碰撞的求解方法。求解过程中我所采用的方法和相对动量具有等效性。)
如果采用相对动量的方法去处理化学反应问题,分子中原子间的结合能就可以化归到原子间的结合状态上。分子间的碰撞在发生相互反应的过程中,是解释化学分子发生分解与组合的最为可能的原因。可以这么说,在化学反应过程中,除了分子间的碰撞之外,我们找不到其它的原因使化学反应发生。
如果我们将分子中原子间的结合状态看成类似于某种势能如电势能或者引力势能类似的存在状态,(虽然这两者在势能的状态上或者相互作用的模式存在不同,但是原子势能和其它势能在力的性质上来说,或者不同能量发生转化的原因上,两者的性质是相同的)采用力的解释模式对分子结合状态进行描述,那么可以建立和传统化学中对化学反应过程不同的解释方法。同时,对于解释微观物质本身属性的一些问题也有一定的启发。
通过如上,您可以看到,采用力学的方法解决化学的实际问题是可行的。但是,这需要改变能量的定义。就如我在本站其它的文章中所说的这需要将能量的定义改称动量的形式。并且这对于解释物质分子发生的化学反应,采用的常规的理解方式是存在可行性的。
关于采用力学的方法处理化学反应的一些实际的问题
1、化学反应的必要条件
化学物质发生化学反应除了必需的化学条件之外(两种物质是否可以发生化学反应),还必须存在特定的物理条件。前面我们已经考虑过这个问题,即:温度的限制
关于这样一个条件,我们是可以进行试验验证的。根据传统化学中物质反应的规律,(元素周期律以及价键结构)化学反应的发生只和核外电子的分布规律或者说和海外最外层电子数目有关,它们直接决定了两种化学物质能否发生化学反应的最直接的原因。但是,化学反应还必须具备特定的物理条件,这个特定的物理条件就是发生相互反应的两种物质分子,必须存在特定的相对运动状态。在上面,我把这一化学反应必需的特定条件用一个较为精确的词汇来描述,把它叫做分子间的相对动量。
这一条件是必需的,两种化学物质的反应可以发生,那么两种物质分子的相对运动状态必须大于这一基本的相对运动状态————即:相对动量
我们可以进行如下的检验:将任意两种可以发生相互反应的化学物质,降低到特定的温度,如接近绝对零度,而后使将两种物质放在一起,并使两种物质的温度回升。那么,当物质的温度回升到确定的数值时,两种物质即可发生化学反应。
在进行如上的检验过程中,两种物质发生化学反应的确定的温度也许会存在微小的变化,因为根据分子运动论,两种化学物质在运动过程中某一瞬时碰撞的相对动量虽然存在确定的关系,但是也存在一定的偶然性,下面我们就要讨论这个问题。
2、分子运动速度的统计规律。
一百年前,近代物理的开端就是将物理的描述范围开拓到分子领域,对微观分子的描述早已经趋近于完善,对微观物质分子运动状态的描述,比较有名的是玻尔兹曼分布率和麦克斯韦速度分布率。这里就不再针对微观物质分子的运动状态分布规律作讨论了,只是根据化学反应的条件提一点不同的看法。或者从物质运动变化的角度提一点形成微观物质分子确定存在状态的原因。也许和传统的看法会存在不同。(这一部分内容可以说是机械运动能量体系中关于温度和物质分子运动关系的延续)
物质分子在不停的运动已经是一个不可否认的事实,确定空间内的气体分子的存在状态,热力学中采用熵的概念来对此进行描述,这只能描述宏观统计上物质分子的某种统计状态,(更确切的说是描述的与气体分子的某种宏观状态相关的数理关系,将它应用与微观物质分子的存在状态是不对的,当然更不可能对微观分子的存在状态进行描述了。统计物理学中采用微观分子可行性的可能性的描述模式如自由度的概念,作为对微观物质运动状态进行统计描述的方法,这对微观的描述仍然是存在问题的。
我们知道,一个分子沿空间自旋转动。在旋转方向上会存在两种可能,顺时针和逆时针。沿空间三个方向(三个维度)会存在六中可能。我们采用统计的方法是将于物质某种存在状态所拥有的物质运动的描述状态平均到这六种可能性上。对于描述大量的分子,这是一种比较好的方法。但是在分子某一时刻相对于一确定的参照系,只会存在一种可能。它拥有的能量标度与我们采用均分的方法所得出的数值是不相符的。
另一方面,物质世界的化学反应给与我们另一个经验事实,物质间化学反应的发生存在确定的温度。我们可以采用化学反应来判定化学物质运动变化的行为规范,或者间接检验微观物质宏观统计描述与微观物质实际的存在状态存在的可能性的行为规范。
传统物理学中对微观物质分子的描述方法采用统计规律来描述,但是如果考察两种可进行化学反应的气体在某一温度状态气体分子的运动速度,从物理宏观统计上得出的结论应该和两种气体所进行化学反应的实际存在状态应该是相同的。依据物质化学反应,在低于物质的燃点以下,两种物质不会发生化学反应。也就是说确定的温度,物质分子的运动量度低于某一数值。这是由化学反应的经验事实所给定采用宏观统计方法进行微观物质分子运动状态的描述不能逾越的一个界限。
在本文或者本站中其它对物质分子运动状态的描述中,是将物质气体分子的相对动量作为可发生化学反应的两种化学分子发生化学反应的依据。这是根据力学得出的结论。(传统物理学中是采用动能作为分子运动具有的能量的标准。即:分子质量与运动速度平方成积的二分之一)关于相对动量的定义,对于完全弹性碰撞可以采用一个物体在弹性碰撞过程中其动量变化量作为和它相互作用的物体间的相对动量。对于完全非弹性物体,可以采用它在两个物体相互作用过程中的两倍的动量变化量作为相互作用物体间的相对动量。对于发生化学反应的两种气体分子,应该采用发生化学反应以前两分子的动量变化量之和。
采用传统物理中的描述方法描述微观物质的运动状态,即采用统计物理学的描述方法,两种化学物质分子间的相互作用是采用量子论的方法进行描述的,不是采用可理解的力学的的方法进行描述。(它是采用数理逻辑关系进行描述的)。采用本文的描述方法对化学物质间的化学反应进行描述,化学物质发生化学反应的温度如果为一常数,那么在宏观统计上,两种化学分子间的化学反应的发生,两种化学分子的相对动量必然大于某一确定的值。
因此,两种可发生化学反应的物质,它的化学反应的温度携带了分子运动状态的信息。我们可以根据化学反应的温度,判定分子的温度和分子运动状态的关系。根据化学物质的燃点可以判定,并确定温度所对应与某一种物质的运动状态,这种物质分子的运动速度存在某一上限。或者更精确的说,在物质发生化学反应的温度以下,可发生化学反应的物质分子间的相对动量不会大于某一确定的值。更进一步的推断,物质分子的运动速度不会大于某一确定的值。
我们可以通过可发生化学反应的两种物质分子在一定温度下并存来检验物质间发生化学反应的物质运动状态的条件。比如,将两种可发生化学反应的物质分子在略小于其燃点温度下并存,检验两种分子发生化学反应在一定温度下的发生率,以常规判断,在低于燃点下的两种化学物质可以并存,两种化学物质不会发生化学反应。在并存一定时间之后,我们检验物质分子在总体分子中的含量,就可以对物质分子运动状态(运动速度)进行判定了。如果并存的两种化学物质的分子的含量不变,那么就说明两种化学物质间没有发生化学反应。同时也说明物质分子运动状态低于某一确定的值。
-------------------------------------
3、物质分子价键模式与化学反应相关可行性结构 的看法
一个分子中所存在的相同的、不同的原子,它们之间的结合状态是由什么决定的呢。原子间的距离较大,强相互作用和弱相互作用自然与此无关。因此电磁作用是解释分子中原子之间相互作用的唯一的力。
传统物理学中对此的处理方法,是采用量子论的方法进行描述的,我们只能根据量子论所确立的数理关系判定原子发生运动变化前后的两种不同状态间的关系,尤其是化学领域,这种方法对于描述不同物质间的化学反应是很成功的。但是将物质的运动变化归因于力学,恐怕量子论就不能胜任了,尤其是我们探讨任意化学反应的某一微观过程。
关于电磁理论中确定带电粒子间的相互作力的一个定律——库仑定律,在深入到原子的领域是存在问题的,关于这一问题,您可参阅库仑定律的适用范围和原子论,本站中的。
分子中的原子的结合状态和原子的空间结构存在着确定的关系,我个人的看法和传统物理学中的看法是存在分歧的。因此,此一部分内容,在这样的前提来说是存在争议的。至于下一部分的推论。我个人暂时以保留的态度。因为在两个定义体系中去谈论原子的结构或者更进一步的分子的结合状态,是没有意义的。但我个人这样认为:
将微观物质运动变化归因于微观物质实体因受到作用力而改变自身的存在状态,作用力是使物质发生运动状态变化的唯一的原因。将分子间的相互作用归因于微观实体间力的相互作用,是探讨微观物质运动变化过程可行性的方法,同时也是判断微观物质在运动变化过程中某一瞬时状态的唯一可行性的方法。如果要想对微观物质的认识进一步深入下去,这是极为重要的方法。或者说,从相互作用的角度出发,是认识微观物质间相互作用的首要方法。(与此相关的看法,您可以参阅下一部分内容)
-------------------------------------
4、依据力学的化学反应得出的和量子论得出的一个不同的结论(关于这一部分内容中分子中原子核外电子的分布规律,在原子论中虽然是根据力的属性进行可行性的推倒而得出的静态原子模型的模式,我建议您将它作为可能性的一种模式)
关于这一结论,必不可少的要涉及到原子的某种存在状态。因此,我在这里就勉为其难了,谈一点可能性的结构模式:
如果分子中原子间的存在状态是以力学的结构而结合的,那么,力学可能性的结构模式应首推分子中原子间的势能了。常规物理学中描述类似的存在状态采用势垒的概念。
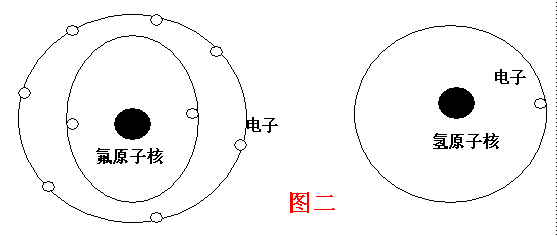
| 如图一: 在这里我仍然延续传统物理学中的基本解释方法,将分子中原子的核外电子仍然看作是有八个构成,并结合成稳定的分子结构。 您也可以将原子核外结构看成是静态的。采用我的看法中的电子在核外空间中的分布规律,如图三: |
 |
 |
在图一中,我只画出分子中原子核的最外层电子结构,这是按传统化学中化学反应分子结构的看法。只是您必须注意的是。这张图也不是标准的,只是说明一个分子中原子的电子的共用状态,您不能也无须将这张图看作是传统化学中分子间原子分布规律的真实的图,或者看作是一张关于分子中原子最外层电子排布规律的二维图解,这张图只是为了说 |
| 明分子中原子存在的某种可能性,而作的一张说明性的简图。 您可以看到,传统中化学分子中原子在空间中的分布没有任何力学的依据。这是由原子的轨道理论所决定的。虽然原子的轨道理论很成功的解释了原子现象,但是这是建立在实验事实与数理关系上。但用于解释物质分子在化学变化过程中的变化过程,是很不成功的。这主要来源于化学物质的本身的力学性质。 首先如下几点不能成功的解释: 1、如果化学分子中的不同的原子或者相同的原子,是以最外层电子进行化 |
 |
 |
和的,化学物质分子中的原子的键价结构主要依赖于最外层电子的结合状态,那么,如图一中的那样,这样的化学分子不能保证化学分子的稳定性。 我们知道,气体分子或者孤立存在的分子,都是在以空间为位移在运动,气体分子在不断的碰撞。即使是固体,也仍然在它固有的位置震动。分子的存在可以说随时经历着巨大的力的作用(精确的说是冲力),另一方面,气体分子的运动速度是很高的,就以氢分子为例:氢分子在摄氏零度时的运动速度就已经达到几千米每秒。那么,两个原子之间依靠一对电子的结合力,是无论如何也不能保证化学分子在运动变化过程中的稳定性的。 2、在化学分子以原子最外层电子结构的 |
结合中,它没能解释化学反应必须需要确定的温度,换句话说,静止的两种可以发生化学反应的物质在发生化学反应的温度以下,可以并存的经验事实。在日常生活中,逾出煤气罐的煤气不和空气中的氧气分子发生化学反应。
3、化学物质进行化学反应必须需要确定的温度,化学分子的键价理论对这一问题的解释还存在一定的困难。
4、通过键价理论,不能确定化学分子的反应过程。即:分子中原子的解构与结构。不需要时间的运动变化过程是不存在的。
这是仅从化学的角度上来说的,如果您对此感兴趣的话,您可以参见本站中的原子论、电的作用等对原子问题解释说明性的东西。这里仅就化学反应有关的问题来说明化学物质的分子结构。
建立在这样的经验事实的基础上,我通过对原子结构可能存在的形式进行了分析,如图二、图四、图三,三张简图试说明化学分子原子的化学结构的可能存在的模式。
如图二,在原子没有发生化学反应的时候,它的存在状态我仍然沿传统物理学中关于原子的轨道理论中的看法,虽然这一理论对化学分子的解释不能算是成功的,但是由于目前不能解决元素周期律的力学结构的问题,我暂时仍然按传统原子结构中的看法,以便能说明这一问题。但我必须说明的是,图中围绕原子核的大圆圈,并不是传统原子中的看法——轨道的意思,而是为了能方便的画电子的空间位置而作的辅助线,图中的电子位置并非真实的电子位置,而是根据原子中力学的特点,而作的说明原子中电子在力学中可能性的分布规律的说明性的东西。在某种意义上来说,它类似于对电子解释的几率的解释。但是在这里,电子所代表的就是电子本身,不是波,而是电子的实体。它说明的是在原子某种状态下,力学中电子在核外空间中的真实位置。如上对原子的图解是将原子核外的电子看作静止的力学结构,虽然由于分子的运动分子会存在震动、转动,单项对于分子本身,电子相对于原子核是静止的。
依据传统化学中元素周期表,原子和分子最外层电子仍然是采用八个电子作为分子稳定性的结构。但依据力学的方法,(您可以参见化学反应过程原子间电子的分布规律〈本文仍在整理之中〉)
当分子没有受到其他的作用力的时候,原子核外的电子是一种以原子核为中心电子为外层结构的力学分布状态,如图二,两个原子的自由分布状态。当两个原子由于运动相互接近时,核外电子由于受到另一个原子的作用,原子核外的电子在空间中的分布规律发生变化,其分布规律仍然按力学的规律进行分布,如图四。两个分子在化合反应后生成氟化氢分子,如图三。分子中和外电子在核外分布的规律已经不同于两个孤立的原子的分布状态。
在这种解释中,请您分清如下一个问题。上面所说的过程是氟原子和氢原子化合的事实,是一种吸热过程。它和传统中化学的实际过程是不同的,实际的过程是放热过程。(详细的请您参见化学反应过程原子间电子的分布规律)
我们假设孤立的两种氟、氢原子的情况,单独的氟、氢原子在日常生活中的环境中很难孤立存在的,这里我们假设在高温状态,虽然氢、氟原子孤立存在状态已经是离子状态了,或者称为等离子状态。此间的化学反应是不能发生的,因为原子间的运动速度很高,碰撞时的相对动量很大。这时两种分子间没有任何的吸热和放热过程,而只是在碰撞。
这样,违反能量守恒定律的现象就会发生了。具体可通过如下过程并可以通过实验进行检验。
将氢气和氟气单独加热到几千度的温度(加热到等离子状态),如果此时的温度为确定数值的温度,然后再用特殊的装置将它们混合到一起,这时,两种气体的温度不会增加,仍然维持特定的温度(也可能存在较小的变化,这是由于两种分子的质量是不同的)。而后再将混合气体冷却到常温状态。这时混合气体已经不再是两种原子了或者两种气体了,而是氟化氢气体。
在这个过程里,加热气体所需要的能量和冷却气体所吸收的能量几乎是相等的。但是,如果考虑到能量守恒和转化定律,我们加热气体所用的能量应远小于冷却气体所吸收的能量,因为氟和氢两种元素的反应过程是必然要放热的,并且燃烧值是很大的。这样的结果和能量守恒和转化定律是不符的。
关于处理化学反应的物理方法
化学虽然是处理物质运动变化的另一个领域,但是它处理的对象仍然不能脱离物质本身的范畴,它研究的也仍然是物质的运动变化规律,在这种意义上来说,它是物理的一部分。只是它所研究的是在特定物理条件下,物质运动变化的属性问题。
如果我们承认物质的结构是由微观物质的相互作用而支撑的,如果物质是以实体的形式而存在,那么构成微观物质并形成运动变化原因的就一定是作用力、作用,这是符合物质运动变化规律的一种逻辑。
我们去解构物质运动变化规律,去探讨物质运动变化的属性问题,那么,采用物质本体作为我们研究的实体,我们采用力的方法是合理的。
物质世界的复杂性虽然我们可以采用很多规律对它进行解释,但是我认为,采用力的方法(物质间相互作用的方法)是最基本的解释方法。这是由物质运动变化的因果规律所决定,即物理的逻辑。当然,这不是物理逻辑的全部,还必须加上空间和时间。
关于化学反应所存在的物理环境
传统化学中,对物质运动变化规律的描述存在特定的化学环境。在物理中所给出的范围是太低的温度化学反应不会发生,太高的温度化学反应没有任何意义。
化学反应的环境是分子的运动状态变化在不破坏原子间可能存在稳定结构的可能状态下。采用物质运动给它定义,则是这样的模式 :原子间的相对动量不低于某一确定数值......不高于某一确定数值......。
在这里,您可以看到,化学只是物理描述物质运动变化的一个常规的领域。
关于本文的一点说明:在我上中学的时候,曾看到过一篇文章,给我印象最深刻的是文中提到惰性元素也可以参加化学反应。这样一个事实让我进行了一段较长时间的思考,一直到我工作几年之后,我思考的结果是采用力学的方法去解释化学规律是唯一符合物质运动变化原理的合理的方法。本着这样一个途径,作为一种尝试。
志勰
2000.5.9
![]() 版权所有,保留一切权力,未经授权使用将追究法律责任 版权说明 © Copyright Authors
版权所有,保留一切权力,未经授权使用将追究法律责任 版权说明 © Copyright Authors
物理科学探疑